تخریب ارتباطات عصبی علت آلزایمر
بنظر می رسد التهاب میتواند در تخریب ارتباط بین سلولهای عصبی توسط خودشان نقش داشته باشد.
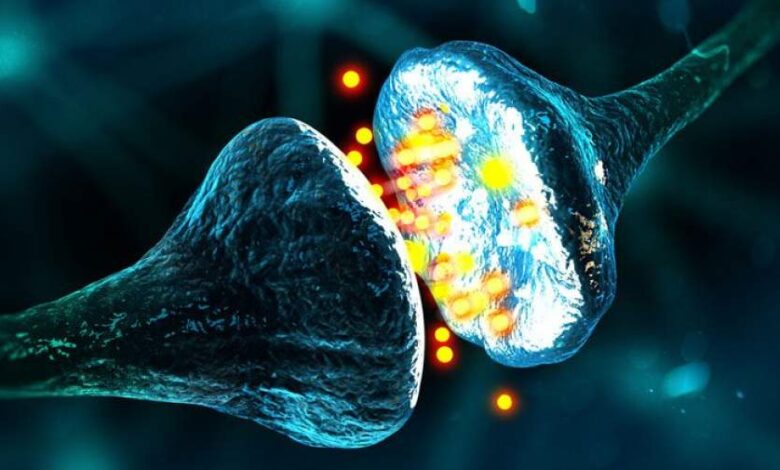
پژوهش تازهای نشان میدهد بیماری آلزایمر ممکن است با فعالکردن یک «کلید مولکولی» مشخص، مغز را فریب دهد تا ارتباطات عصبی خود را از بین ببرد؛ فرآیندی که بهطور مستقیم به تخریب حافظه منجر میشود. این مطالعه که در مؤسسه علوم اعصاب وو تسای دانشگاه استنفورد انجام شده، نشان میدهد تجمع آمیلوئید بتا و التهاب مغزی، هر دو از طریق یک گیرنده مشترک باعث حذف سیناپسها میشوند که نقاط اتصال حیاتی میان سلولهای عصبی هستند.
آلزایمر بیش از هر چیز با نابودی تدریجی سلولهای مغزی و شبکههای عصبی شناخته میشود؛ شبکههایی که امکان ذخیره و بازیابی خاطرات را فراهم میکنند. با این حال، چگونگی آغاز این تخریب همچنان مورد بحث است. تاکنون عوامل متعددی از جمله پروتئین آمیلوئید بتا، پروتئینهای تاو، اختلال در لیزوزومها، التهاب مزمن و نقش سلولهای ایمنی مغز (میکروگلیا) در این بیماری مطرح شده بود.
به گزارش پایگاه علمی خبری دانه، پژوهش جدید که نتایج آن در نشریه Proceedings of the National Academy of Sciences منتشر شده، تلاش کرده است دو نظریه مهم درباره منشأ آلزایمر را به یکدیگر پیوند دهد. بر اساس این یافتهها، آمیلوئید بتا و فرآیندهای التهابی هر دو به یک مسیر مولکولی مشترک میرسند و گیرندهای را فعال میکنند که به نورونها،سلولهای عصبی دستور حذف سیناپسها را میدهد.
این تحقیق به سرپرستی «کارلا شاتز» از مؤسسه علوم اعصاب وو تسای و با همکاری «باربارا برات» انجام شده است. شاتز سالهاست روی گیرندهای به نام (LilrB2) کار میکند؛ مولکولی که نقش کلیدی در «هرس سیناپسی» دارد؛ فرآیندی طبیعی که در رشد مغز و حتی یادگیری در بزرگسالی رخ میدهد.
حذف سیناپسها توسط نورون
پیشتر مشخص شده بود که آمیلوئید بتا میتواند به این گیرنده (LilrB2) متصل شود و نورونها را به حذف سیناپسها، محل ارتباط بین سلولها،وادار کند. آزمایشها همچنین نشان داده بودند که حذف ژنتیکی این گیرنده در مدلهای حیوانی، از بروز اختلال حافظه جلوگیری میکند.
در بخش دیگری از این پژوهش، دانشمندان به بررسی نقش التهاب و «آبشار کمپلمان» پرداختند؛ سامانهای ایمنی که بهطور طبیعی در حذف عوامل بیماریزا و سلولهای آسیبدیده نقش دارد. با توجه به ارتباط شناختهشده التهاب با آلزایمر، این پرسش مطرح شد که آیا مولکولهای التهابی نیز میتوانند همان گیرنده (LilrB2) را فعال کنند یا نه.
نتایج نشان داد تنها یک جزء از این آبشار، یعنی قطعه پروتئینی (C4d)، توانایی اتصال مؤثر به این گیرنده را دارد. آزمایش تزریق (C4d) به مغز موشهای سالم نشان داد که این مولکول بهتنهایی قادر است سیناپسها را از نورونها حذف کند؛ یافتهای غیرمنتظره، زیرا پیشتر تصور میشد (C4d) نقش عملکردی مشخصی ندارد.
این نتایج حاکی از آن است که هم آمیلوئید بتا و هم التهاب میتوانند از یک مسیر مشترک، به حذف سیناپسها و تضعیف حافظه منجر شوند. چنین برداشتی دیدگاههای رایج درباره مکانیسم آلزایمر را به چالش میکشد و نشان میدهد نورونها قربانیان منفعل نیستند، بلکه خودشان بهطور فعال به این سیگنالها پاسخ میدهند و در فرآیند حذف ارتباطات عصبی مشارکت دارند.
لزوم حفاظت از سیناپسها
این یافتهها پیامدهای مهمی برای درمان آلزایمر دارند. در حال حاضر، تنها درمانهای تأییدشده عمدتاً بر شکستن پلاکهای آمیلوئیدی متمرکزند؛ داروهایی که اثربخشی محدود و عوارض جانبی قابل توجهی دارند. پژوهشگران معتقدند هدفگرفتن گیرندههایی مانند (LilrB2) و حفاظت مستقیم از سیناپسها میتواند رویکردی مؤثرتر برای حفظ حافظه باشد.
به گفته پژوهشگران، این مطالعه نشان میدهد برای مقابله با آلزایمر، تمرکز صرف بر آمیلوئید کافی نیست و باید مسیرهای مولکولی دخیل در حذف سیناپسها نیز بهطور جدی مدنظر قرار گیرند.